Photo Credit: Daniel Peckham via Compfight cc
永野数学塾の「虎の巻」を公開する「語呂合わせと徹底整理で攻略する高校無機化学」シリーズ7回目の今日は2族のマグネシウムとアルカリ土類金属篇です。
このシリーズをまとめたものは↓
2族元素は大き分けて2つのグループに分かれます。1つは下の周期表の青枠のとBe(ベリリウム)、Mg(マグネシウム)。もう1つは赤枠のCa(カルシウム)、Sr(ストロンチウム)、Ba(バリウム)、Ra(ラジウム)です(Raはほとんど出題されません)。
赤枠の4つの元素は互いに性質がよく似ているのでアルカリ土類金属と呼ばれます。
アルカリ土類金属の性質
アルカリ土類金属(Ca、Sr、Ba)の性質
- 炎色反応を示す。※
- 常温の水と反応して水素発生。
Ca + 2H2O → Ca(OH)2 + H2↑ - 水酸化物が水に溶けて強塩基
- 硫酸塩が水に難溶
Be、Mgはアルカリ土類金属と逆の性質を持つ。
※ Mgは強熱すると明るい光を出して燃焼
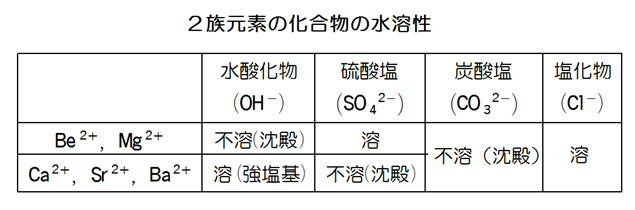
ちなみにアルカリ土類金属の「土」というのは、その酸化物が水に溶けにくく、熱にも強いことから名付けられました。次に2族元素の化合物の水溶性についてまとめておきます。
アルカリ土類金属のイオンや鉛(Pb)のイオンを含む水溶液に炭酸イオン(CO32-)や硫酸イオン(SO42-)を加えると白色沈殿を生じます。この事は試験でもよく聞かれるので語呂合わせを紹介しておきましょう。
次は2族の化合物について見ていきましょう。特にCaの化合物が重要です。
Caの化合物
CaCO3(炭酸カルシウム)
- 生石灰(せいせっかい)。
- 水を注ぐと激しく発熱しながら反応して、白色粉末状の水酸化カルシウム(消石灰)になる。
CaO + H2O → Ca(OH)2 - コークス(C)を混ぜて強熱すると炭化カルシウム(カーバイド:CaC2)※が得られる。
CaO + 3C → CaC2 + H2O
※ カーバイドに水を加えると、アセチレン(C2H2)ができる。
CaC2 + 2H2O → Ca(OH)2 + C2H2
↓生石灰が水と反応して発熱する様子の動画
Ca(OH)2(水酸化カルシウム)
- 消石灰(しょうせっかい)。
- 飽和水溶液は石灰水(塩基性) 。
- CO2を通じると、炭酸カルシウムの白色沈殿を生じる。
Ca(OH)2 + CO2 → CaCO3↓ + H2O
さらに通じると、炭酸水素カルシウムを生じて無色の溶液になる。
CaCO3 + CO2 + H2O ←→ Ca(HCO3)2
この反応の正反応により鍾乳洞が、逆反応により鍾乳石や石筍(後述)ができる。
CaSO4(硫酸カルシウム)
- 2水和物は石膏(せっこう)。
- [latex] \dfrac {1} {2} [/latex]水和物は焼き石膏※
※ CaSO4・2H2O(石膏)は120~140℃に加熱するとCaSO4・[latex] \dfrac {1} {2} [/latex]H2O(焼き石膏)になる。これを水で練って放置すると再び石膏(2水和物)になって固まる固まる性質があることから、ギブスなどに使われている。
CaSO4・2H2O ←→CaSO4・[latex] \dfrac {1} {2} [/latex]H2O + [latex] \dfrac {3} {2} [/latex]H2O
CaCl2(塩化カルシウム)
- 空気中の水分を吸収する乾燥剤(潮解性がある)。
※ NH3を含む気体にはCaCl2・8NH3を作るので使用できない。
CaCl(ClO)・H2O(さらし粉)
- Ca(OH)2(消石灰)に低温で塩素を充分に吸収させると得られる
Ca(OH)2+ Cl2 → CaCl(ClO)・H2O - 殺菌・漂白作用があり※、プールの消毒などに使われている。
※ 組成式を2倍するとCaCl2・Ca(ClO)2・2H2Oになることから、さらし粉は塩化カルシウムと次亜塩素酸カルシウムの複塩であることがわかる。
さらし粉を水に溶かすと各成分イオンのCa2+、Cl-、ClO-にぞれぞれ電離する。次亜塩素酸イオンは強い酸化作用を持ち、殺菌・漂白作用を示す。さらし粉はドイツ語でクロールカルキ、略してカルキとも呼ばれ、プールの消毒などによく用いられる。
Caの化合物ではありませんが以下の化合物も重要です。
BaSO4(硫酸バリウム)
- 水に難溶
- X線造影剤
CO2(二酸化炭素)を過剰に加えると沈殿が溶ける理由
水酸化カルシウムの水溶液にCO2を過剰に加えると沈殿が溶けるのは、炭酸カルシウムが炭酸水素カルシウムに変わるからです。
炎色反応
アルカリ土類金属もアルカリ金属と同様に炎色反応を示すので以下にまとめておきます。
金属元素の中にはその化合物の水溶液を白金線につけてガスバーナーの外炎にいれると炎の色が変化するものがあります。この反応を炎色反応といいます。
鍾乳洞、鍾乳石、石筍
鍾乳洞、鍾乳石・石筍に関しては上記の各項目ほどには頻出分野ではありませんが、綺麗な写真を載せたいので書きます(^_-)-☆
鍾乳洞

Photo Credit: kendrick via Compfight cc
- CaCO3を多く含む石灰岩地帯ではCO2が溶けた地下水によって
CaCO3 + CO2 + H2O → Ca(HCO3)2
の化学的侵食が起こり、長い年月をかけて洞窟(鍾乳洞)ができる。
鍾乳石・石筍
- Ca(HCO3)2を多く含んだ水が石灰岩の割れ目に沿って流れ落ち、鍾乳洞の天井からゆっくりとにじみ出ると空気中にH2OとCO2が放出されるので鍾乳洞ができる時の逆反応が起こり
Ca(HCO3)2 → CaCO3 + CO2 + H2O
により、CaCO3が析出する。これが長い年月をかけてつらら状になったものが鍾乳石でこの水滴が地面に落ちて同様にCaCO3が析出し、たけのこ状になったものが石筍(せきじゅん)である。
鍾乳石 
Photo Credit: ComputerHotline via Compfight cc
石筍 
Photo Credit: SamuraiCatJB via Compfight cc