Photo Credit: John C Williams via Compfight cc
Photo Credit: John C Williams via Compfight cc
永野数学塾の「虎の巻」を公開する「語呂合わせと徹底整理で攻略する高校無機化学」シリーズ8回目の今日は両性元素・水銀・合金篇です。
このシリーズをまとめたものは↓
今回は
- 12族:亜鉛(Zn)と水銀(Hg)
- 13族:アルミニウム(Al)
- 14族:スズ(Sn)と鉛(Pb)
と合金について学んでいきます。このうちHgをのぞく、Zn、Al、Sn、Pbは酸とも塩基と反応する両性元素です。
まずは両性元素全般に言える性質から!
両性元素
一般に金属は「塩基性」であり、イオン化傾向が水素よりも小さい金属(金、銀、銅、白金、水銀)を除くすべての金属は酸に溶けて水素を発生します。
- 例)2Na + 2HCl → 2NaCl + H2↑
ただし、金属の中で両性元素と呼ばれる次の4つの金属は酸だけでなく強塩基の水溶液とも反応し、水素を発生して溶解します。
両性元素:Al(アルミニウム)、Zn(亜鉛)、Sn(スズ)、Pb(鉛)
また両性元素の酸化物や水酸化物も酸と強塩基の両方に反応して溶けます。
それでは各元素について詳しく見ていきましょう。まずはアルミニウムから。
アルミニウム Al
- 両性金属(単体も酸化物も水酸化物も酸と塩基の両方に溶ける。)
単体Alの反応
- 2Al + 6HCl → 2AlCl3 + 3H2↑
- 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
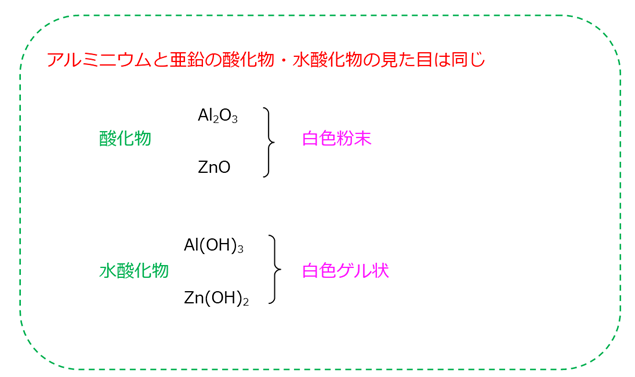
酸化物Al2O3(白色粉末)の反応
- Al2O3 + 6HCl → 2AlCl3 + 3H2O
- Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
水酸化物Al(OH)3(白色ゲル状)の反応
- Al(OH)3 + 3HCl → AlCl3 + 3H2O
- Al(OH)3 + NaOH → 2Na[Al(OH)4]
単体も酸化物も水酸化物も酸や強塩基に溶けたときの錯イオンが同じであることに注意しましょう。
Al粉末と酸化鉄(Ⅲ)Fe2O3の混合物(テルミットという)に点火すると、反応と共に多量の熱が生じて融解したFeが生成します。この反応をテルミット反応といいます。Alは大変酸化されやすく強い還元力を持ち、Alの燃焼熱は金属中で最大です。
↓高校の化学部が文化祭で演示実験したそうです。
不動態
Al、Fe,Niの各金属は濃硝酸や濃硫酸と不動態を作り反応しません。これは金属の表面に安定で緻密な酸化被膜が生じこれが内部を保護するためですが、このように金属が本来反応すべき状態にあるにもかかわらず、化学的に反応性を失ってしまった状態を不動態といいます。
アルミニウムの製錬
原料にはボーキサイト(主成分はAl2O3・nH2O)を用います。このボーキサイトには不純物としてFe2O3(酸化鉄(Ⅲ))やSiO2(二酸化ケイ素)が含まれるので、これからまず純粋なAl2O3(アルミナ)を取り出します※1。アルミナは融点が高いので氷晶石(Na3AlF6)を融解させたものに混合して融点を下げ、炭素電極を用いて融解塩電解※2を行い単体のアルミニウムを得ます。
AlK(SO4)2・12H2O(ミョウバン)
- 硫酸アルミニウムAl2(SO4)3と硫酸カリウムK2SO4から成る複塩(2種以上の塩が一定の割合で結合した塩)で、水溶液は弱酸性。
- 結晶は無色透明の正八面体をしており、加熱すると六水和物 → 無水和物(粉末)と変化する。
- 上水道の清澄剤、染色の媒染剤、紙のにじみ止め(サイジング)など利用されている。
亜鉛Zn
単体Znの反応
- Zn + 2HCl → ZnCl2 + H2↑
- Zn + 2NaOH → 2H2O → Na2[Zn(OH)4] + H2↑
Zn単体が酸や塩基に溶けるときはZnがZn2+になったときに放出される電子(e-)をH2Oの電離によって生じたH+が受け取るので水素(H2)が発生する。
酸化物ZnO(白色粉末)の反応
- ZnO + 2HCl → ZnCl2 + H2O
- ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
水酸化物Zn(OH)2(白色ゲル状)の反応
- Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
- Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
※ 亜鉛は両性金属の中で唯一、水酸化物が弱塩基のアンモニア水とも反応して錯イオン(テトラアンミン亜鉛(II)イオン)を作り溶解する(AlとSnとPbの水酸化物は強塩基でないと溶解しない)。
Zn(OH)2 + 4NH3 → [Zn(NH3)4]2+ + 2OH-
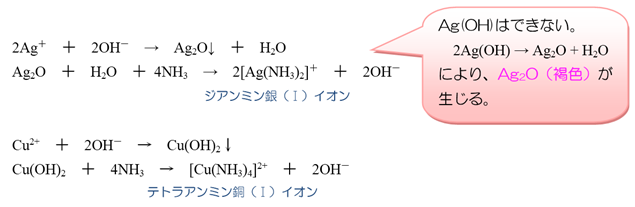
他に銅(II)イオンや銀(I)イオンも塩基性下で沈殿{Cu(OH)2やAg2O}を生じるが,
これにアンモニアを過剰に加えると沈殿が溶ける。
スズSn
- 両性金属。
単体Snの反応
- Sn + 2HCl → SnCl2 + H2↑
Sn2+はSn4+に酸化されやすいので、SnCl2は強い還元力を持ちます。
- Sn + 2NaOH + 4H2O → Na2[Sn(OH)6] + H2↑
AlやZnと同様にSnがSn2+になった際に放出する電子e-をH2Oの電離によって生じたH+が受け取って水素(H2)が発生します。
鉛Pb
- 両性金属。
- 酸化数は+2と+4。
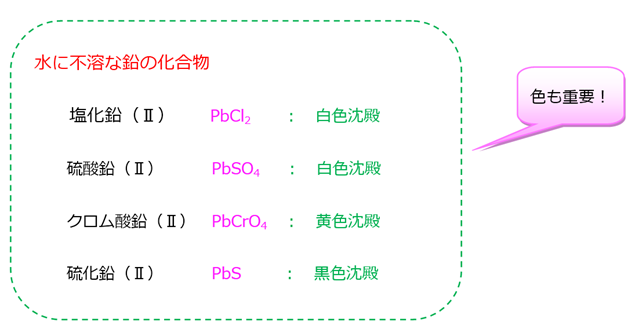
- 化合物は水に不溶なものが多い。
- 放射線を遮蔽(しゃへい)。
鉛は水に不要な化合物が要チェックです。
※ 鉛は水素よりイオン化傾向の大きい物質であるが、塩酸HClや硫酸H2SO4には白色沈殿を作るため、溶けない。
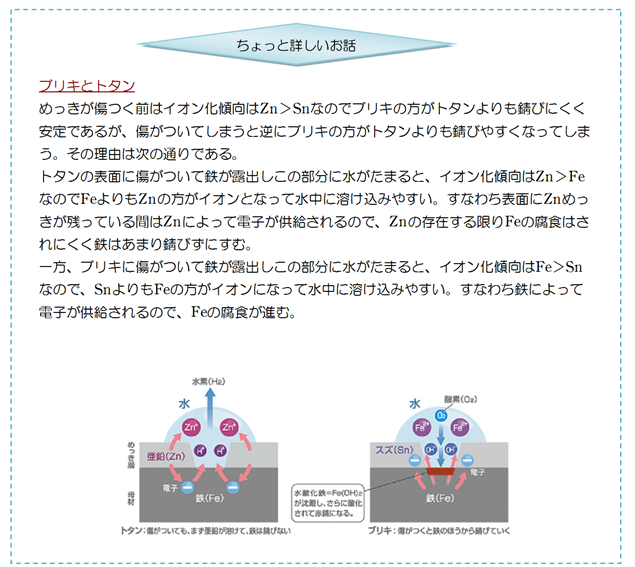
めっき
トタン
- 鉄(Fe)に亜鉛(Zn)のめっきをしたもの。
ブリキ
- 鉄(Fe)にスズ(Sn)のめっきをしたもの。
以上で両性金属は終わりです。ここで酸化物の性質についてまとめておきます。
最後に水銀と合金について見ておきます。
水銀Hg
単体Hg
水銀の塩化物
- 塩化水銀(I)Hg2Cl2 : 甘汞(カンコウ)ともいい、水に不溶の白色沈殿。無毒
- 塩化水銀(II)HgCl2 : 昇汞(ショウコウ)ともいい、水に可溶の無色の結晶。猛毒。
水に不溶の塩化物には他にAgClやPbCl2もありますが、AgClは過剰のアンモニアに溶け、PbCl2は熱湯に溶けます。Hg2Cl2は過剰のアンモニアにも熱湯にも溶けないので他の2つと区別することができる。
合金
有名な合金をまとめておきます。
黄銅
- Cu、Zn … 美しく加工しやすい。(日用品)
 五円硬貨。銅60-70%、亜鉛40-30%の黄銅製。
五円硬貨。銅60-70%、亜鉛40-30%の黄銅製。
青銅
- Cu、Sn … 硬く美しい。(美術品、機械部品)
 十円硬貨。銅95%、スズ1-2%、亜鉛4-3%の青銅製。
十円硬貨。銅95%、スズ1-2%、亜鉛4-3%の青銅製。
白銅
- Cu、Ni … 加工しやすい。(貨幣)
 百円硬貨。銅75%、ニッケル25%の白銅製。
百円硬貨。銅75%、ニッケル25%の白銅製。
- Al、Cu、Mg、Mn … 軽くて強度が大きい。(航空機材)
 ジュラルミン製のケース
ジュラルミン製のケース
ステンレス鋼
- Ni、Cr … 電気抵抗が大きい。(電熱線)
 ニクロム線を利用した電気こんろ
ニクロム線を利用した電気こんろ
はんだ
- Pb、Sn … 融点が低い。(金属の接着)
無鉛はんだ
- Sn、Cu、Ag …融点が低い。(金属の接着)
 左: 無鉛はんだ 右: 有鉛はんだ
左: 無鉛はんだ 右: 有鉛はんだ






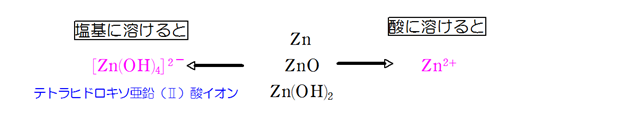


 トタンの倉庫
トタンの倉庫 ブリキのおもちゃ
ブリキのおもちゃ