photo credit: myfuture.com via photopin cc
永野数学塾の「虎の巻」を公開する「語呂合わせと徹底整理で攻略する高校無機化学」シリーズ5回目の今日は、気体の製法と性質です。ここは試験でも頻出の分野ですのでしっかり勉強していきましょう!!少し長くなりますが、できるだけ体系立ててまとめましたので語呂合わせも参考にしながら、がんばってください!!
このシリーズをまとめたものは↓
気体の製法には大きく分けて以下の2つのパターンがあります。
- 酸と塩基の反応
- 酸化還元反応
それぞれを詳しく見ていきましょう。
酸と塩基の反応による気体の製法
酸と塩基の反応によって気体が発生するのは以下の3つのメカニズムのいずれかによるものです。
ここで強酸と強塩基にはどのようなものがあったか復習しておきましょう。
強酸:HCl、HNO3、H2SO4
強塩基:NaOH、KOH、Ca(OH)2、Ba(OH)2
酸と塩基の強弱は、ここにあげた強いものを覚えて、他は弱いと覚えましょう!
ではいよいよ具体的に気体の製法を見ていきます。
A 弱酸の塩 + 強酸 → 強酸の塩 + 弱酸↑
二酸化炭素CO2
石灰石 + 希塩酸
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
硫化水素H2S
硫化鉄 + 希硫酸
FeS + H2SO4 → FeSO4 + H2S↑
二酸化硫黄SO2
亜硫酸水素ナトリウム + 希硫酸
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑
B 弱塩基の塩 + 強塩基 → 強塩基の塩 + 弱塩基↑
アンモニアNH3
塩化アンモニウム + 水酸化カルシウム【 加熱 ①※ 】
2NH4Cl + Ca(OH)2 → CaCl2 + 2H2O + 2NH3↑
※ 加熱については後でまとめます。①などの数字は分類です。
C 揮発性酸の塩 + 不揮発性酸 →不揮発性酸の塩 + 揮発性酸↑
塩化水素HCl
塩化ナトリウム + 熱濃硫酸【 加熱 ② 】
NaCl + H2SO4 → NaHSO4 + HCl↑
「揮発性の酸」は塩化水素とフッ化水素(HF)、「不揮発性の酸」は濃硫酸だけを覚えておけば大丈夫です。
酸化還元反応による気体の製法
酸化・還元反応によって気体が発生するのは以下の4つのメカニズムのいずれかによるものです。
「イオン化傾向」について復習しておきましょう。イオン化傾向とは金属を陽イオンになりやすい順にならべたものでしたね。
- このように水素よりイオン化傾向の大きい金属は酸化力のない酸にも溶けて水素を発生します。
- Cu、Hg、Agは酸化力のある酸(硝酸や濃硫酸)に溶けて、NO 、NO2 、SO2 等を発生します。
- 王水とは濃硝酸と濃塩酸を1:3で混合したものです。
A 水素よりイオン化傾向が大きい金属 + 酸
水素H2
亜鉛 + 希硫酸
Zn + H2SO4 → ZnSO4 + H2↑
B 水素よりイオン化傾向が小さい金属 + 酸化力のある酸
一酸化窒素NO
銅 + 希硝酸
3Cu + 8HNO3 → 3Cu(NO3)2 + 4H2O + 2NO↑
二酸化窒素NO2
銅 + 濃硝酸
Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2↑
二酸化硫黄SO2
銅 + 熱濃硫酸【 加熱 ② 】
Cu + 2H2SO4 → CuSO4 + 2H2O + SO2↑
C 酸化剤 + 還元剤
塩素Cl2 (あとで詳しく触れます)
酸化マンガン(Ⅳ) + 濃塩酸【 加熱 ③ 】
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2↑
酸素O2
過酸化水素【 MnO2 触媒 】
2H2O2 → 2H2O + O2↑
過酸化水素は酸化剤にも還元剤にもなる物質でしたね。
H2O2 → O2 + 2H+ + 2e-(還元剤)…①
H2O2 + 2H+ + 2e- → 2H2O(酸化剤)…②
①+②より
2H2O2 → 2H2O + O2
D 熱分解
酸素O2
塩素酸カリウム【 MnO2 触媒 】【 加熱 ④ 】
2KClO3 → 2KCl + 3O2↑
窒素N2
亜硝酸アンモニウム【 加熱 ④ 】
2NH4NO2 → 2H2O + 2N2↑
ここで、加熱が必要な反応についてまとめておきます。
上の【 】の中の丸数字は下の丸数字に対応しています。

photo credit: Degilbo on flickr via photopin cc
次は気体の発生装置です。
気体の発生装置
個体と液体【加熱不要】
① 二叉試験管
突起のついた方に固体を、もう一方に液体を入れる。気体を発生させたい時は管を矢印の方向へ倒し、液体を固体の方に入れる。気体の発生を止めたい時は元に戻す。
② 三角フラスコ
三角フラスコの中に固体を入れ、滴下ロートのコックを開いて、液体を適量滴下した後、またコックを閉じておく。滴下ロートの先は必ず液面下にあるようにする。
③ キップの装置
活栓を開くとB内の圧力がさがって、液体試料がAから流下し、Cを満たしてBまで入ってくるので固体試料と液体試料が接触して気体が発生する。
活栓を閉めると、発生した気体がB内に閉じ込められ、その圧力で液体試料をBからCに押し下げるので固体試料と液体試料が離れ、気体の発生が止まる。
④ 丸底フラスコ
丸底フラスコの中に固体を入れ、滴下ロートから液体を注ぐ。
三角フラスコを用いると割れるおそれがある。
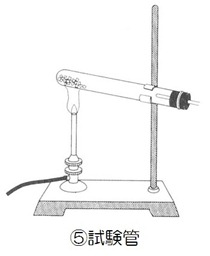
⑤ 試験管
発生した水蒸気が逆流して試験管が破裂するのを防ぐため
試験管の口を少し下げる。
次は気体の補修方法と乾燥剤についてまとめておきます。
気体の捕集方法
水上置換 … 水に不溶な気体:( H2、O2、 N2、CO、 NO )
上方置換 … 水に可溶で空気より軽い気体※:( NH3 )
下方置換 … 水に可溶で空気より重い気体:( Cl2、HCl、SO2、H2S 等)
※ 空気の平均分子量:約28
乾燥剤
酸性乾燥剤 … 濃硫酸 、P4O10
乾燥剤として使えない組み合わせ
酸 + 塩基 【理由:中和反応を起こしてしまうのでダメ】
アンモニア + 塩化カルシウム 【理由:CaCl2・8NH3という化合物を生成するのでダメ】
硫化水素 + 濃硫酸 【理由:H2Sは還元性があるからダメ】
乾燥剤には上のように酸性、中性、塩基性のものがありますが、発生する気体と反応する乾燥剤を使うことはできません。つまり酸性の気体には塩基性の乾燥剤を、塩基性の気体には酸性の乾燥剤を使わないようにします。また特定の物質を生成する組合せも使えません。

photo credit: pasukaru76 via photopin cc
気体の性質
ここでは気体の性質についてまとめておきます。
中性の気体(=水に溶けない気体)
塩基性の気体
酸性の気体
有色の気体
漂白作用のあきる気体
次は気体の製法の中で実験器具を含めて特に出題されやすい塩素の製法について詳しく学んでおきましょう。ハロゲン篇でも書きましたが、念のため(^-)-☆
塩素の製法と精製
酸化マンガン(Ⅳ)に濃塩酸を加えて加熱すると、塩素が発生する。
揮発した塩化水素HClが混合するので、水の入った洗気びんに通じて、HClを溶かして除いた後、
混入した水蒸気を濃硫酸で乾燥する。
気体の検出
最後に気体の検出についてまとめておきます。
CO2 の検出
- 石灰水に通じるとCaCO3の白色沈殿。
ただし、過剰に通じるとこの沈殿は溶ける。
CO2 + Ca(OH)2 → CaCO3↓ + H2O
CaCO3 + CO2 + H2O → Ca(HCO3)2
NH3 の検出
- 塩酸をつけたガラス棒を近づけるとNH4Cl (塩化アンモニウム)の白煙があがる。
- 赤リトマス紙が青変する。
- 溶液はネスラー試薬で赤褐色沈殿。
アンモニアに塩酸をつけたガラス棒を近づけると白煙があがる様子の動画
ちなみに、塩化アンモニウムは再結晶させると綺麗な星形の結晶になります(^-)-☆
Cl2、O3 の検出
- ヨウ化カリウムデンプン紙が青変する。
Cl2もO3も酸化力があるのでヨウ化物イオンが酸化されて、
2I- → I2
により、ヨウ素が生成しこれがデンプンとヨウ素デンプン反応を起こす。
H2S の検出
- 酢酸鉛(CH3COOPb)をぬったろ紙に触れるとPbSを生じて黒変する。
以上です!お疲れ様でした。繰り返しますが、気体の製法と性質は超頻出分野です。
がんばってくださいね(^_-)-☆