photo credit: oh estelle via photopin cc
photo credit: oh estelle via photopin cc
永野数学塾では化学も教えていますが、私自身が大の暗記嫌い(というか大の苦手)なので、化学も数学同様極力、「なぜそうなるのか?」を説明しながら授業しています。
しかし、特に無機化学の分野はどうしても暗記せざるを得ないことが多いため、語呂合わせを使ったり、全体を体系だてて整理したりしています。そんな私のいわば「虎の巻」を、暗記が苦手な高校生の皆さんや、高校化学をおさらいしてみたい大人の方のために公開します!(←我ながら太っ腹w)。少しでも皆さんのお役に立てれば幸いです。
ちなみに、ここに書いてあることを頭に入れておけば、センター試験の無機化学分野は80~90%得点できるはずです!
初回の今日はハロゲンです。
このシリーズをまとめたものは↓
ハロゲン(17族)
ハロゲンというのは下記の元素周期表において右から2 列目(17 族)の
F(フッ素)、Cl(塩素)、Br(臭素)、I(ヨウ素)、At(アスタチン)
のことですが最後のAt(アスタチン)は知らなくても大丈夫です。
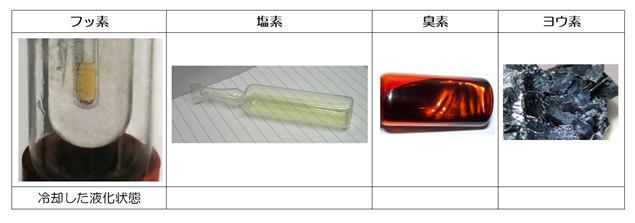
次の表にハロゲン単体の性質をまとめておきます。特に赤字になっているところがテストに出題されるので、要注意です!
ハロゲン単体の性質
ハロゲン単体は色がよく聞かれます。基本的に周期表の下にいくほど濃い色になりますが、フッ素と塩素は有色の気体としても有名です。高校数学でおさえておきたい有色の気体は他に、二酸化窒素(NO2:赤褐色)とオゾン(O3:淡青色)がありますが、まとめて語呂合わせで覚えてしまいましょう。
ハロゲンの酸化力(反応性)
ハロゲンは周期表の上にあるものほど反応性が激しくなります。一般に周期表の右上にいくほど電気陰性度(電子を引きつける力)は強くなりますが、電子を引きつける力が強いということは、それだけ酸化力が強いということです。
ハロゲン化水素
次はハロゲンと水素の化合物、すなわちハロゲン化水素です。ここで電気陰性度が極端に強いフッ素だけは仲間はずれになっていることに注意です。
※ フッ素は電気陰性度が大変高いために陰性が強く、陽イオンであるH+を強く引きつける。これにより分子間に水素結合が働き、弱酸になったり沸点が高くなったりする。またガラスの主成分はSiO2である。
ハロゲン化銀
ハロゲンと銀の化合物(ハロゲン化銀)についても見ておきましょう。
ハロゲン化銀は、水やアンモニア水やチオ硫酸ナトリウム水溶液への溶解性も重要です。
表にまとめておきましょう。
※1 周期表の下にいくほどAg との電気陰性度の差が小さくなり、共有結合性が増すので溶け難い。
※2 チオ硫酸ナトリウムには錯イオン [Ag(S2O3)2]3― を作り可溶。
※3 AgCl はアンモニア水を過剰に加えると溶ける。
↓ はハロゲン化銀の沈殿実験。
フッ素の特異性
とにかく、フッ素はハロゲンの中で特殊なので、特異性をまとめておきます。
- HFは沸点が異常に高い(分子間に水素結合を生じるから)。
- HFの水溶液は弱酸。他のハロゲン化水素の水溶液は強酸。
- HFはガラス(SiO2)を侵す。
- CaF2は水に溶けない。他のハロゲンのカルシウム塩は溶ける。
- AgFは水に溶ける。他のハロゲン化銀は水に溶けない。
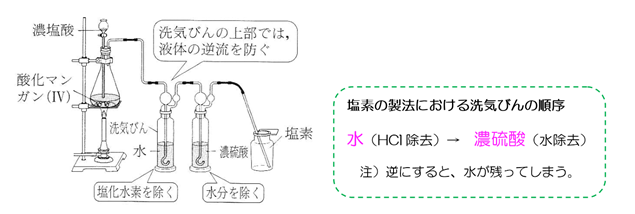
塩素の製法
ハロゲンの製法の内、特によく出題されるのが塩素の製法です。 塩素の製法には2つあります。
↑ 洗気瓶の順序は超頻出問題です。また、反応式はしっかりと作れるようにしましょう。
塩化物イオンによる沈殿
最後に水に不溶の塩化物を確認しておきましょう。 語呂合わせで覚えちゃって下さい(^_-)-☆